理工学部研究年報
自己組織化ナノ材料の超高速合成法の開発
エネルギー化学科 塩月 雅士
1.研究背景と目的
ナノレベルの微細構造構築能を有する次世代材料としてブロック共重合体が注目されている.ブロック共重合体は複数の高分子鎖が互いに共有結合により結ばれた高分子であり,その自己組織化能に基づいて「球」,「シリンダー」,「ラメラ」などの微細構造を構築する(図1).その応用として極微細レジスト材料や太陽電池材料,燃料電池材料,相溶化剤,粘着剤,熱可塑性エラストマーとしての利用が検討されている.近年,ブロック共重合体の様々な用途展開を見据え,その合成手法の改良が望まれている.従来のブロック共重合体の合成手法は、精密リビング重合を用い数種のモノマーを逐次添加、重合する方法の他,末端修飾ポリマーに二次セグメントを導入する方法がある.しかしながら,これら従来法には合成過程の煩雑さや合成可能な高分子の構造に制限があることなどが課題として残されている.
以上の背景を踏まえ,本研究では新たなブロック共重合体合成法の開発を目的として,一分子内に多点反応部位を有する新規重合開始剤を開発する.これを複数のポリマー原料の混合系に投入することで複数の高分子鎖を同時に生長させる超高速ブロック共重合体合成法の確立を目的とした.
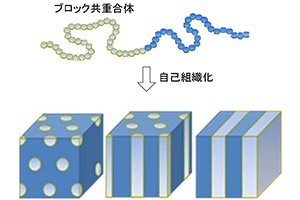
ナノレベルのドメイン構造の例.
2.研究方法
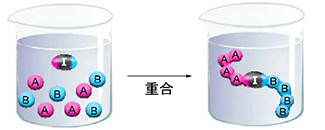
本研究では上記を達成するため単分子内にラジカル部位とイオン部位の双方を重合活性点として併せ持つ重合開始剤の開発を行った.実際には、図2 および図3 に示すDistonic ラジカルイオン重合開始剤(1+-)1)を新たに合成し,これを2種のモノマー混合系に用いることでブロック共重合体の合成を検討した(図2).ひとつの重合系でイオン重合とラジカル重合を同時に進行させブロック共重合体を得るという研究は過去に例がない.

3.研究成果
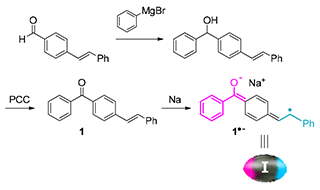
3.1. 新規重合開始剤の合成
Distonic ラジカルアニオン重合開始剤(1+-)の前駆体 (E)-4-benzoylstilbene(1)2)はスキーム1 に示す経路により合成した.化合物1 を金属Na と反応させたところ反応混合物が無色透明から濃赤色に変化した(スキーム1, 図3).ベンゾフェノン類は電子受容によるアニオンラジカルへ変化を経て呈色することが知られている.このことから,本系で化合物1 に由来するDistonic ラジカルアニオン1+-が生成したことが示された.
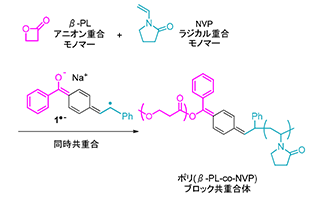
3.2.開始剤1+-によるブロック共重合体の合成
Distonic ラジカルアニオン開始剤1+-をアニオン重合モノマーであるβープロピオラクトン(βーPL)とラジカル重合モノマーであるNービニルピロリドン(NVP)を混合した系に加えることで一段階のブロック共重合体合成を試みた(スキーム2)
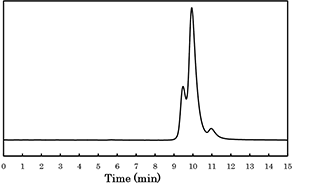
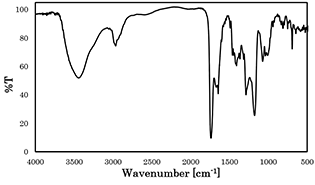
開始剤の添加後は反応の進行に伴って明らかな粘度の向上が見られた.得られた生成物のGPC の結果(図4)では三峰性のピークが観測され,最も分子量が高いものについてはMn = 12,600 であったことから高分子の生成が確認された.生成物のIR スペクトル(図5)によれば,1739,1671 cm-1 にNVP とβーPLのそれぞれに由来するポリマーユニットのC=O伸縮ピークが観測された.一方、生成ポリマーの1H NMR スペクトルをNVP およびβーPL のそれぞれのホモポリマーのスペクトルと比較すると両繰り返しユニットが生成ポリマーに含まれていることが確認された.また、生成ポリマーの各種溶媒のへ溶解性は,NVP とβーPL の各ホモポリマーとは異なっていた.以上の結果は,本重合系により目的のブロック共重合体が生成したことを強く示唆している.
4.今後の展望
以上の結果によりDistonic ラジカルイオンはブロック共重合体合成に有効であることが示された.今回は開始剤の重合能を検討するため用いたモノマーは限定的であったが,今後は他の疎水性モノマーも検討し、生成するブロック共重合体の自己組織化能を検討するなど今後の発展が期待できる.
5.参考文献
2) Alacid, E.; Nájera, C. J. Org. Chem. 2009, 74, 8191-8195.
成果発表一覧
若手奨励支援予算課題に関連する成果公表
1) Sanda, F.; Shiotsuki, M.; Masuda, T. “Controlled polymerization ofphenylacetylenes using well-defined rhodium catalysts” Macromolecular Symposia2015, 350(1), pp. 67-75.
その他の成果公表
2) Sogawa, H.; Terada, K.; Miyagi, Y.; Shiotsuki, M.; Inai, Y.; Masuda, T.; Sanda, F.“Photoinduced formation of an azobenzene-based CD-active supramolecular cyclicdimer” Chemistry – A European Journal 2015, 21(18), pp. 6747-6755.
3) Suzuki, Y.; Miyagi, Y.; Shiotsuki, M.; Inai, Y.; Masuda, T.; Sanda, F. “Synthesis and helical structures of poly(ω-alkynamide)s having chiral side chains: Effect of solvent on their screw-sense inversion”Chemistry – A European Journal 2014,20(46), pp. 15131-15143.
4) Castanon, J. R.; Sano, N.; Shiotsuki, M.; Sanda, F. “New approach to the polymerization of disubstituted acetylenes by bulky monophosphine-ligated palladium catalysts” ACS Macro Letters 2014, 3(1), pp. 51-54.
